yl6809永利官网江云宝教授课题组在手性选择性反应新体系构建研究中取得进展,有关成果近日以 “Heterochiral coupling to bilateral β-turn structured azapeptides bearing two remote chiral centersˮ 为题发表于《自然-通讯》 (Nat. Commun. 2024, 15, 9271)。
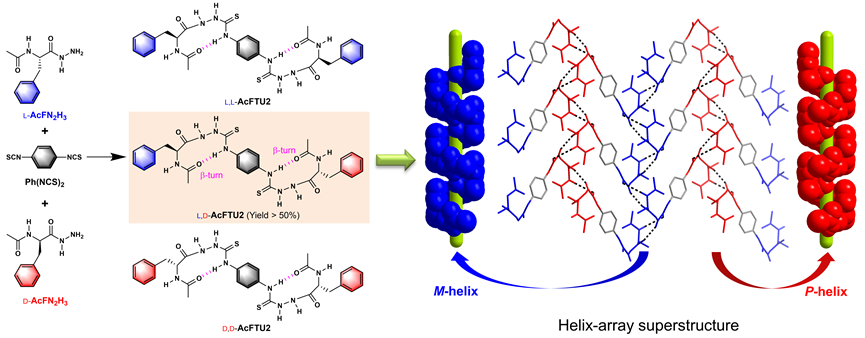
有趣的是,该项研究起因于一个梦境,梦见对苯二异硫氰酸酯与外消旋乙酰基-L-/D-苯丙氨酰肼的反应为异手性偶合!当时实验室正在研究氨基酸酰氨基硫脲的β-转角结构 (Chem. Commun. 2013, 49, 8943),一直思考的是转角之间如何结合而使转角螺旋结构的螺旋性得以有效延展。酰基氨基酸酰肼与结构对称的对苯二异硫氰酸酯反应得到的产物中含有两个β-转角结构,经由对苯基二硫脲中的硫酰胺基-NH参与的两个十元环分子内氢键经苯环关联。大胆的实验设想很快便获得了实验验证。异手性产物的比率远高于统计值50%、高达84%,于异手性偶合产物晶体结构中观察到丰富的同手性的β-转角结构之间的相互作用,保障了β-转角螺旋性的有效传递,形成左手和右手螺旋交替的螺旋阵列;而同手性偶合产物在晶体结构中仅平行排列,不利螺旋性传递。理论计算表明,异手性产物的分子间作用力更强,溶液相聚集特性和溶解度参数等进一步佐证,揭示了异手性选择性的驱动力。值得指出的是,偶合产物中两个手性中心间虽远隔14个原子,但因分子内β-转角螺旋结构和分子间螺旋性传递之故,建立了远程手性中心之间的联系,从而在无手性助剂或催化剂条件下,实现显著异手性选择性反应。
与此同时,借助反应体系的异手性选择性特征,通过去除优先偶合形成的异手性产物,可获得具有更高对映体过量 (ee) 值的反应原料,实现了系列乙酰基氨基酸酰肼的手性放大。研究结果不仅为手性选择性合成机制的发展提供了新的思路,也将有助于手性放大途径的深入理解。
该研究工作在江云宝教授指导下,主要由博士生严小胜(现为厦门大学药学院副教授)完成,博士生曹金莲和硕士生罗欢等参与部分实验工作。黎朝副教授参与了实验讨论,理论计算得到了学院曹泽星教授和厦门大学讲座教授莫亦荣博士的指导。
研究工作得到国家自然科学基金(21820102006、22101240、22241503、92356308)、厦门大学校长基金(20720220005、20720220121)和福建省自然科学基金(2023J01038)的资助。
论文链接:https://www.nature.com/articles/s41467-024-53744-x
