yl6809永利官网王斌举教授课题组在金属酶氧气活化机理研究方面取得进展,相关成果以“Fenton-Derived OH Radicals Enable the MPnS Enzyme to Convert 2-Hydroxyethylphosphonate to Methylphosphonate: Insights from Ab Initio QM/MM MD Simulations”为题发表于《美国化学会志》 (J. Am. Chem. Soc., 2019, DOI: 10.1021/jacs.9b02659)。
生物体内氧气活化主要通过金属酶完成。很多铁酶和铜酶可以活化氧气分子生成不同的含氧金属物种来调控各式各样的氧化反应,比如C-H的活化和官能化、杂原子氧化、C-C键断裂/生成反应等。由于氧气中O-O键能很高(119 kcal/mol), 大多数金属酶中氧气的活化都需要还原剂(电子供体)的参与。还原剂通过向金属-O2供给电子来削弱O-O键的键能。然而,非血红素铁酶MPnS以及HEPD可以在无还原剂参与下催化底物C-H键的活化以及C-C断裂反应。虽然之前实验以及理论对HEPD以及MPnS酶进行了大量研究,但是针对O2分子的活化机理以及相应的酶催化机理仍然不清楚,存在很多争议性。
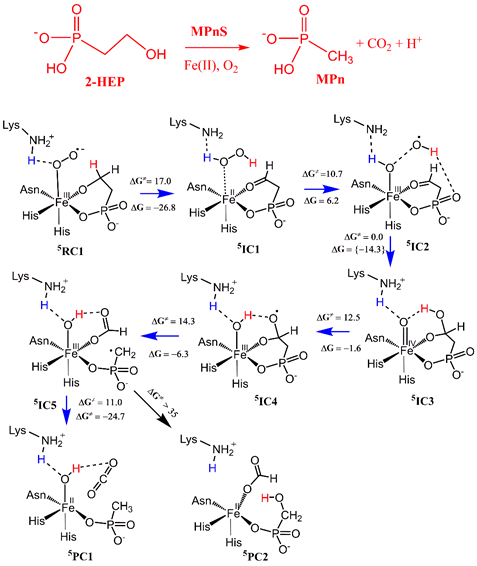
课题组采用QM/MM MD水平上的Metadynamics自由能计算,基于最新解析的MPnS酶的晶体结构,研究了MPnS酶中氧气的活化以及整个催化循环机理。发现活性区间的赖氨酸残基(Lys28)对氧气的活化起关键作用。铁-超氧中间体(Fe(III)-O2-)在夺取底物H原子的同时,Lys28上的质子向Fe-OOH近端O上的转移,生成H2O2中间体。二价铁Fe(II)活性中心进一步通过芬顿反应方式活化H2O2,生成亚稳的OH自由基中间体。OH自由基自发进攻底物羰基碳的同时, Fe(III)-OH上的质子向脱质子的赖氨酸Lys28转移,最后生成实验上检测到的高价Fe(IV)=O活性物种。因此,该研究通过多尺度理论模拟揭示赖氨酸可以通过质子-穿梭机理参与氧气的活化,这极大拓展了我们对金属酶中氧气活化机理的认识。
本研究计算模拟主要由王斌举教授完成,郑州大学宋金帅副教授参与了57Fe穆斯堡参数的计算,所有作者参与了数据分析以及文章撰写。研究工作得到固体表面物理化学国家重点实验室、福建省理论与计算化学重点实验室计算平台的支持,以及厦门大学相关经费的资助。
论文链接:https://pubs.acs.org/doi/abs/10.1021/jacs.9b02659
