yl6809永利官网方柏山教授课题组、王斌举教授课题组和洪文晶教授课题组合作,通过单分子电导原位表征了甲酸脱氢酶催化过程,揭示单分子尺度下甲酸脱氢酶催化过程中有别于教科书经典机制的反应机制,相关研究成果以“Catalytic cycle of formate dehydrogenase captured by single-molecule conductance”(基于单分子电导表征的甲酸脱氢酶催化循环)为题发表在Nature Catalysis (DOI: 10.1038/s41929-023-00928-1)。

酶是生命体中重要的一类行使催化功能的蛋白质机器,不仅为细胞代谢过程提供各种还原力和能量,也是生命活动信号调控中的接受者和传递者。因而,理解酶的功能和机制是生物化学领域的长期目标。目前,系综平均的群体研究方式仍然是酶催化过程的主要研究手段。由于缺乏单分子水平上系统分析酶催化反应过程的表征方法,通过实验解析酶催化机制仍然是合成生物学和生物工程领域的巨大挑战。
该研究基于研究团队建立的单分子电学表征的酶催化反应过程研究平台,发现了甲酸脱氢酶结合还原型或氧化型辅酶I后呈现不同的电导值,该现象不仅可用于区分甲酸脱氢酶催化循环中的不同反应状态,而且可用作监测甲酸脱氢酶催化循环轨迹的标记。基于人工智能的电导数据分析和统计结果表明,单分子电导表征揭示的甲酸脱氢酶催化循环过程与1955年诺贝尔生理学或医学奖得主Theorell教授提出、在教科书上的Theorell-Chance经典机制不同,其催化反应循环结束时并没有经历脱辅酶状态。结合多尺度模拟,该研究提出了催化反应结束后结合在甲酸脱氢酶中的还原型辅酶I通过氢负离子原位转移直接转化为氧化型辅酶I,并直接开启新的催化循环,而这一新机制在能量上是更为有利的。该项工作首次在单分子尺度下观测到酶催化反应动态过程,并结合多尺度理论计算提出了单分子尺度下甲酸脱氢酶催化新机制。该研究还建立了包括单分子电导表征,数据分析和多尺度模拟的完整单分子酶学研究平台,将为后续的单分子酶促动力学,酶的设计和改造等研究提供重要基础。
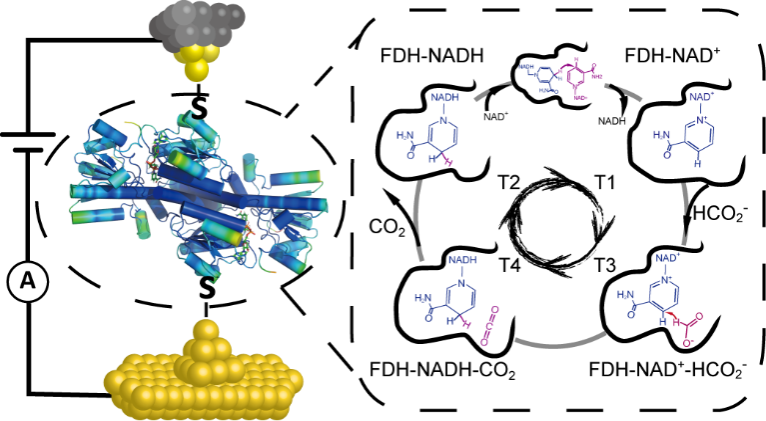
单分子电导表征的甲酸脱氢酶催化反应循环示意图及其催化新机制
该工作是在方柏山教授、王斌举教授和洪文晶教授的共同指导下完成的,yl6809永利官网“博新计划”博士后张瑷珲博士、博士生庄小燕(现为集美大学助理教授)、博士后刘佳博士和硕士生黄佳城是论文的共同第一作者。yl6809永利官网博士后林禄春博士、博士研究生赵世强、李瑞豪、硕士研究生唐永翔也参与了本研究部分工作。该工作得到了国家自然科学基金(21978245、22122305、22250003)、国家重点研发计划课题(2017YFA0204902)、博士后创新人才支持计划(BX20200197)的资助,也得到了固体表面物理化学国家重点实验室、厦门市合成生物技术重点实验室的支持。
论文链接:https://www.nature.com/articles/s41929-023-00928-1
